BIOFISICA| UNICA | DRAGO-LU-JU:7-13hs -1° cuatr. 2024
Ósmosis
Reseña teórica, concepto y ejemplos de aplicación. Definición de osmolaridad. Isotonicidad.
ÓSMOSIS
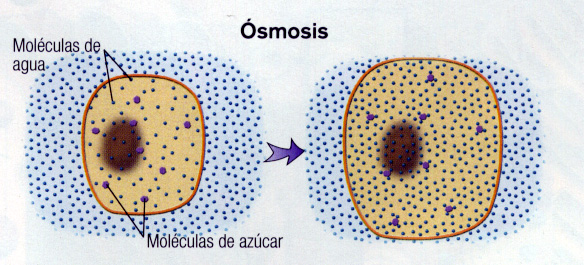
La ósmosis juega un papel fundamental en el funcionamiento de los seres vivos, en general en todos los casos en que hay un pasaje de solventes como el agua a través de las membranas celulares. Hacia mediados del siglo XVIII se observó por primera vez este fenómeno, que consiste en el pasaje de solvente, pero no de soluto, a través de las paredes celulares de plantas y animales. Estas paredes en muchos casos son películas con poros de tamaño tal que permiten el paso de las moléculas “chicas” del solvente pero no de las moléculas “mayores” del soluto. Se las conoce como membranas selectivas al agua o membranas semipermeables. Se observa en diversos campos como la medicina (p.e. el mecanismo de funcionamiento de los riñones), la biología (p.e. la subida de la savia en las plantas, la bioquímica (p.e. determinación de masas moleculares de macro moléculas), entre otros.
Consideremos un recipiente con agua pura que se ha dividido con dos compartimientos separados por una membrana semipermeable. Debido al movimiento molecular las moléculas chocarán con la membrana y atravesarán la misma a través de los canales correspondientes. En este caso, dada la igualdad de presiones entre ambos lados de la membrana, el flujo neto será nulo, o sea que habrá la misma cantidad de moléculas de agua que de muevan del lado izquierdo al derecho que del derecho al izquierdo. Si aplicamos una presión sobre uno de los compartimientos, por ejemplo mediante un pistón colocado sobre el izquierdo, veremos que habrá un flujo neto de moléculas de agua desde este lado al derecho, atravezando la misma como consecuencia de la diferencia de presión ahora existente entre ambos compartimientos.
Disolvamos algún tipo de soluto (para el cual la membrana no es permeable) en el compartimiento izquierdo. Sabemos que en la naturaleza los sistemas tienden a alcanzar algún tipo de equilibrio ¿ Comó es que sucede en este caso? De ser la membrana permeable al soluto veremos que se dá el fenómeno de difusión, pasando partículas de soluto de izquierda a derecha, tendiendo a igualarse las concentraciones a ambos lados de la membrana. Pero como la membrana puede ser atravezada sólo por las moléculas de solvente (agua), las del recipiente derecho comenzarán a pasar hacia el lado izquierdo. ¿ Existe una explicación para este fenómeno, que dijimos, se denomina ósmosis? Dado que al agregar el soluto las moléculas del mismo han desplazado a algunas de las de agua, es decir, la concentración de las moléculas de agua a izquierda es menor que la respectiva concentración del lado derecho, habrá más moléculas de agua que choquen contra los canales de la membrana del lado derecho que del lado izquierdo, causando un movimiento neto de líquido de derecha a izquierda.
PRESIÓN OSMÓTICA
Si ahora en el recipiente de la izquierda ejercemos una presión mediante un pistón como explicamos anteriormente, el flujo neto de agua mencionado disminuirá e incluso se detendrá en caso de aplicarse la fuerza apropiada. El grado de presión que es necesaria aplicar para detener el proceso se denomina presión osmótica, así que se define a la misma como la presión necesaria a aplicar del lado de mayor concentración (de solutos) para impedir el pasaje de agua.
Ahora bien ¿Qué relación existe entre esta diferencia de presión y la concentración de la solución? Pfeffer, en 1885, determinó que la presión osmótica (que simbolozaremos como p) respecto del agua pura era proporcional, en general, a la concentración (molar) de la solución y a la temperatura (expresada en K). Luego se encontró que la constante de proporcionalidad coincidía con R, la constante universal de los gases (0,082 l.atm.K-1.mol-1), por lo tanto:
Π = M.R.T
La ecuación deducida por Pfeffer es válida solamente para soluciones no electrolíticas como analizó Van Hoff (1886) posteriormente. El fenómeno de ósmosis es función del número de partículas, sin importar la naturaleza del soluto (llamadas propiedades coligativas, así como la disminución de la temperatura de fusión, llamada descenso crioscópico, el aumento de la temperatura de ebullición, ascenso ebulloscópico y el descenso relativo de la presión de vapor), sólo interesa que el solvente contenga material extraño disuelto (soluto) que no pase por la membrana (no interesa que clase de membrana sea), y es más intenso cuando mayor sea el número de las mismas. En las soluciones electrolíticas, como sales disueltas en agua, el número aumenta debido a la disociación iónica que se produce al disolverse dichas sustancias en agua y debe agregarse un factor de corrección i a la fórmula anterior para que tenga validez. La determinación del factor de Van Hoff depende del tipo de soluto, concentración y condiciones de presión y temperatura y se determina experimentalmente. Siempre resulta ser un valor que oscila entre 1 y el número de iones que se espera obtener en el caso de que la disociación sea completa. Por ejemplo si se tiene una solución de cloruro de sodio (sal) (NaCl) al disolverse en agua se disocia dando un anión Cl- y un catión Na+. En este caso si se considera que la disociación iónica fuese completa sería i = 2. Este valor teórico es válido para soluciones muy diluidas ya que suele disminuir a medida que la concentración de la solución aumenta, porque al haber un número mayor de moléculas hay más posibilidades de que interactúen entre sí formando enlaces eléctricos y disminuyendo así el número total de partículas libres, por lo que i toma un valor ligeramente menor. Aún más, si la concentración está cerca del estado de saturación se puede observar que i toma valores menores a la unidad por los mencionados enlaces eléctricos. Entonces :
Π = i.M.R.T
Ejemplo 1:
En el recipiente de la izquierda de la segunda figura de la página anterior hay disuelto (totalmente) cloruro de sodio en agua en tanto que el de la derecha contiene agua pura. La concentración de la solución es 0,05 M (0,05 mol/dm3) y la temperatura es de 27ºC. ¿ Cuánto vale la presión osmótica de la solución?
De acuerdo con los datos tenemos que:
Podríamos preguntarnos que fuerza debemos ejercer sobre la solución de NaCl para detener el flujo de solvente. Supongamos para ello que el área superior del recipiente sea de 0,1 m² así que:
Osmolaridad
Para expresar la concentración de sustancias osmóticas en lugar del número de moles se utiliza una unidad llamada osmol, que es el número de moles del soluto multiplicado por el factor i de Van Hoff si hay disociación electrolítica. Por ejemplo, 180 g de glucosa tiene una masa de 1 mol (MR glucosa = 180) y como la glucosa no se disocia (i=1) esta cantidad corresponde a 1 osmol. Pero 58,8 g de NaCl tiene una masa de 1 mol y, suponiendo que se disocia completamente (i=2), corresponderá a 2 osmoles. Cuando la concentración se expresa como el número de osmoles por litro de solución se denomina osmolaridad.
La osmolaridad normal de los fluidos corporales es de 300 miliosmoles por litro de solución (0,3 osmoles, similar a una solución al 0,9 % de NaCl).
Osmolaridad = Molaridad.i
Ejemplo 2:
Un recipiente dividido en dos por una membrana semipermeable contiene una solución 0,1 M de CaCl2 en el compartimiento izquierdo(A) y el mismo volumen de una solución 0,1 M de NaCl en el derecho (B)
¿ Cuál es la osmolaridad de cada solución?
Cada molécula del CaCl2 se disociará en tres iones por lo que i =3 ( CaCl2 à Ca++ + 2Cl-) por lo tanto:
Para la solución de NaCl en donde i=2 tenemos:
¿ Cuál es el sentido del flujo de solvente?
Evidentemente la solución con más partículas de soluto (mayor concentración osmolar) es la del recipiente A por lo que pasará agua desde B hacia A para tender a equilibrar las concentraciones.
¿ Cuánto vale la diferencia de presión osmótica presente si la temperatura es de 10 C?
Podemos calcular la presión osmótica de cada solución respecto del agua pura y una vez determinadas estas estableceremos la diferencia de presión entre ambas soluciones:
EQUILIBRIO
¿ Llegarán a igualarse las concentraciones de las soluciones del ejemplo anterior como consecuencia de que el pasaje de agua determina que aumente la concentración en B a la vez que disminuye la de A?
Esto en realidad depende de otros factores que en este caso dependen de la forma de los recipientes y su disposición. El pasaje de solvente provoca una disminución del nivel de líquido den B y el consecuente aumento del mismo en A. Paulatinamente este desnivel establece una diferencia de presión (presión hidrostática) que finalmente detendrá el pasaje de solvente antes de que se alcance la igualdad de las concentraciones a ambos lados de la membrana. Considerando que por tratarse de soluciones muy diluidas el equilibrio se establese al alcanzarse un cierto desnivel h sin que haya cambios significativos en las concentraciones iniciales, podemos decir que al detenerse el flujo de agua la presión osmótica resulta igual a la presión (hidrostática) ejercida por dicho desnivel:
Ejemplo 3:
La savia de los árboles se puede considerar como una disolución de sacarosa (C12H22O11) en agua de concentración 8,55 g/dm3 y cuya densidad puede suponerse igual a la del agua. Calcular hasta que altura puede llegar subir la savia por presión osmótica en un día en que la temperatura ambiente es de 35 C
Como decíamos anteriormente, la diferencia de concentraciones entre dos recintos acuosos separados por una membrana semipermeable origina una presión llamada osmótica, generándose un flujo de solvente desde el recinto menos concentrado hacia el de mayor concentración. En este caso el recinto más concentrado es el del interior del árbol considerando la solución de sacarosa, separado del recinto externo el cual lo consideraremos compuesto de agua pura (lo cual es solo una aproximación). El agua que ingresa asciende por los capilares irrigando las zonas superiores del árbol. Para conocer hasta que altura llega esta debemos expresar la concentración en forma molar. Consultando los pesos atómicos en una tabla periódica vemos que un mol de sacarosa contiene 342 g/dm3. Por lo tanto:
8,55 g/dm3 ________________ x = 0,025 mol
Esta diferencia con la concentración exterior (recordemos que a esta la consideramos nula) genera una presión osmótica de:
Al ascender la savia se ejerce una presión hidrostática que equilibrará a la anterior, y de allí podemos despejar la altura alcanzada por la savia:
Nota: Este ascenso es debido exclusivamente al proceso osmótica, la savia asciende a mayores alturas por otro fenómeno denominado capilaridad.
ISOTONICIDAD
Observamos este fenómeno de manera cotidiana. Un ejemplo común lo vemos al hacer “compota”, el caso de una ciruela en agua. La piel de la ciruela actúa como una membrana semipermeable donde los azúcares de la ciruela son los solutos. En este caso la ciruela se sumerge en un medio hipotónico, o sea, cuya concentración osmolar es menor que la del interior de la fruta.El agua entra a la ciruela a través de la piel y la fruta se hincha hasta que se rompe. En los jardines habitan unos “bichitos” un tanto desagradables, llamados comunmente babosas. Para matarlas podemos arrojar cierta cantidad de sal sobre la misma se modo de que la concentración de esta sea mayor que la de los fluidos del interior del cuerpo. De este modo al actuar la piel de la babosa como una membrana semipermeable, saldrá solvente del cuerpo de la misma deshidratándola. . En este caso la babosa está inmersa en un medio hipertónico, o sea, cuya concentración osmolar es mayor que la de su interior.
Si retiramos un grupo de glóbulos rojos y los sumergimos en agua pura, ¿qué creen que podrá pasar?. Como la concentración dentro del glóbulo es mayor que en el exterior comenzará un proceso osmótico, la pared celular permite que el agua fluya al interior, la pared se extiende hasta que finalmente se rompe o se hace tan permeable que permite a los solutos dentro de la célula escapar de ella (se hace permeable a los solutos), a este fenómeno se lo denomina plasmólisis.
Por otro lado, si otro grupo de glóbulos los sumergimos en una solución salina con una concentración osmótica mayor a la del plasma (recordemos 300 miliosmoles) ahora será mayor la concentración en el exterior del glóbulo y entonces habrá un flujo osmótico de agua hacia fuera del glóbulo, encogiéndolo y deshidratándolo. Esto es muy importante para la preparación de inyecciones endovenosas ya que si la solución a inyectar no tiene la mismo osmolaridad del plasma (isotónica o isosmótica) se producirían los trastornos antes mencionados, ya que de tener una osmolaridad menor (hiposmótica) al plasma producirá hichamiento y eventual estallido de glóbulos rojos y si es de una osmolaridad superior (hiperosmótica) provocará además del cambio de volumen globular grandes desplazamientos de agua entre los compartimientos orgánicos, lo que puede llevar hasta a la muerte de un paciente. En medicina el efecto osmótico se utiliza, por ejemplo, en dietas libres de sal en caso de una retención alta de fluidos en el cuerpo
Osmosis inversa
La figura nos muestra un recipiente formado por una membrana semipermeable que contiene una solución mas concentrada en su interior sumergido en otro cuya concentración sea menor. Veremos que hay un ingreso osmótico en el recipiente en donde el líquido se eleva por sobre el nivel externo una altura h. Ya explicamos que de aplicar una fuerza como se indica, podríamos ejercer una presión similar a la presión osmótica y detener el ingreso del líquido. Ahora si aplicamos una fuerza ligeramente superior lograríamos entonces que el flujo se dé en el sentido contrario al espontáneo. Este fenómeno se denomina ósmosis inversa y es usado, por ejemplo, en los transatlánticos para obtener agua pura a partir de agua salinilizada.
¿Cuánta energía mínima se requiere para llevar a cabo un proceso de este tipo? En este caso el trabajo a realizar será, como ya sabemos, equivalente al producto de dicha fuerza por la distancia Dh que debe desplazarse el émbolo. Dicha fuerza puede expresarse como el producto de la presión osmótica por el área del émbolo
A su vez fíjense que el producto entre el área A y el desplazamiento Dh es equivalente al volumen del fluido desalojado:
Por lo que el trabajo, que se le llama trabajo de volumen, es igual al producto de la presión osmótica existente por el volumen del líquido que atraviesa la membrana.
En general interesa conocer la potencia necesaria para lograr este proceso. Como la potencia es igual al trabajo por unidad de tiempo y recordando que el caudal volumétrico es el cociente entre el volumen y el tiempo podemos decir que la potencia es igual al producto de la presión osmótica por el caudal de volumen Qv.
Ejemplo 5:
Suponga que debe obtener en un transatlántico agua a partir del agua de mar. Si entre el agua de mar y el agua desalinizada existe una presión osmótica de 500 kPa y el valor de la energía eléctrica es de $ 0,5 el kWh ¿ Cuánto cuesta desalinizar una tonelada de agua de mar por osmósis inversa?
Vimos anteriormente que la energía necesaria para el proceso de ósmosis inversa era proporcional a la presión osmótica existente por el volumen desplazado (recordemos que 1 tonelada de agua ocupa un volumen de 1 m3)
Luego: 3.600.000 J ________________ 1 Kwh
500.000 J _________________ x = 0,139 Kwh
Finalmente: 1 Kwh _________________ $ 0,5
0,139 Kwh _________________ x = $ 0,0695
